Уравнение электрокапиллярности
Основное уравнение электрокапиллярности было выведено Фрумкиным:
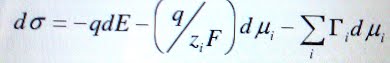
где
q – заряд единицы поверхности,
σ – обратимая поверхностная работа,
Е – потенциал поверхности электрода,
zi – заряд i-ого компонента,
μi – химический потенциал i-ого компонента
F – постоянная Фарадея,
Гi – адсорбция (поверхностный избыток) i-ого компонента.
Казалось бы, мало ли уравнений было выведено учеными? Даже для уравнения электрокапиллярности существует несколько форм записи, чем же так знаменито именно это? Как мы видим, в представленном уравнении оказались связаны воедино важнейшие характеристики двойного электрического слоя. Пользуясь им, можно легко рассчитать одни величины на основе других, уже установленных экспериментально. О значении уравнения электрокапиллярности можно догадаться, исходя уже из его названия — ведь не зря же оно зовется основным.
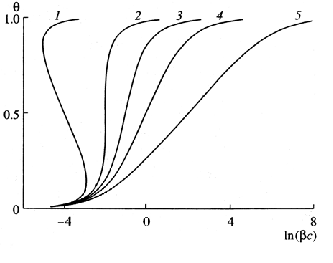
Зависимость заполнения поверхности органическим адсорбатом
от потенциала
Зависимости заполнения поверхности могут быть получены экспериментальным путем (из электрокапиллярных кривых или из кривых дифференциальной емкости), а также теоретически на основании расчетов, основанных на моделировании адсорбционных явлений изотермой Фрумкина.
Низкая степень заполнения поверхности, характерная для высоких положительных и отрицательных зарядов электрода, обусловлена индуцируемой зарядом десорбцией органического вещества,
т.е. вытеснением электростатическим полем диэлектрика с низким значением электрической проницаемости. При низких значениях заряда поверхности наблюдается значительная степень заполнения. Наклон участка кривой между потенциалами десорбции органического вещества объясняется специфическими взаимодействиями частиц в адсорбционном слое.
Характерные участки десорбции на кривых дифференциальной емкости отражаются в виде пиков.
А. Н. Фрумкин, изучая зависимости степени заполнения поверхности адсорбатом от потенциала, предлжил изотерму, описывающую адсорбцию органических соединений на электродах
(которая сразу и незатейливо была названа изотермой Фрумкина).
А. Н. Фрумкин, изучая зависимости степени заполнения поверхности адсорбатом от потенциала, предложил изотерму, описывающую адсорбцию органических соединений на электродах (которая сразу и незатейливо была названа изотермой Фрумкина).
Для модельных описаний адсорбционных явлений традиционно используют разные эмпирические изотермы адсорбции. На основании анализа кривых дифференциальной емкости и зависимостей степени заполнения поверхности адсорбатом от потенциала было предсказано, что изотермы адсорбции многих органических веществ должны иметь S-образную форму, что свидетельствует о взаимодействии адсорбированных частиц между собой. Фрумкин в 1925-26 гг. предложил изотерму, выведенную из изотермы Ленгмюра с учетом взаимодействия между частицами адсорбата (по аналогии вывода уравнения Ван-дер-Ваальса состояния газа из уравнения Менделеева-Клапейрона).
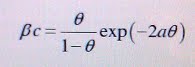
где:
β — константа адсорбционного равновесия, являющаяся некоторой функцией потенциала;
Θ — степень заполнения поверхности адсорбатом;
с — объемная концентрация адсорбирующегося вещества;
а — параметр межмолекулярного взаимодействия адсорбированных частиц.
При а>0 изотерма описывает притягательное взаимодействие, если a<0 — отталкивательное. При а=0, что
эквивалентно отсутствию взаимодействий, изотерма Фрумкина превращается в изотерму Ленгмюра.
(На рисунке выше представлены изотермы адсорбции, при различных значениях параметра а: 1–4, 2–2, 3–1, 4–0, 5–2)
Следует отметить, что в западной литературе коэффициент (-2а) часто заменяется аттракционной постоянной g.
Портрет Фрумкина или немного о том, что коллоидная химия - искусство

В 1965 году О. А. Петрий и Р. Марвет создали от имени Пабло Пикассо творческий портрет
А. Н. Фрумкина, посвященный его 70-летию.
Коллекция знаменитых электрохимических
кривых, из которых сложился облик юбиляра,
является своего рода учебным пособием по
классическим методам исследования заряженных межфазных границ и электродных процессов.
