
Франческо Сельми (7 апреля 1817 г. – 13 августа 1881 г.) – итальянский химик, один из основателей коллоидной химии. Родился в Виньоле (в то время – Моденское герцогство). С 1840 года заведовал химической лабораторией в Модене, с 1867 года – профессор фармакологии и токсикологии в Болонском университете.
Основные работы посвящены химии коллоидов. В 1845-1850 гг. выполнил первое систематическое исследование неорганических коллоидов (хлорида серебра, берлинской лазури и серы). Известно, что эти вещества нерастворимы в воде и при определенных условиях выпадают в осадок. Однако системы, полученные Сельми, почти прозрачные по внешнему виду, были очень похожи на истинные растворы, к которым относятся, например, растворы хлорида натрия или сульфата меди в воде. Сельми полагал, что ни сера, ни хлорид серебра, ни ряд других веществ не могут находиться в воде в виде таких же мелких частиц, образующихся при растворении хлорида натрия и сульфата меди в воде, т. е. в виде отдельных молекул или ионов. Ученый описал аномальные свойства коллоидных растворов: рассеивание света, образование осадка при добавления к ним небольших количеств солей, отсутствие взаимодействия между растворенным веществом и растворителем. Сельми назвал такие системы «псевдорастворами». Он доказал, что характерным отличием псевдорастворов (или ложных растворов) от истинных растворов является то, что образование их не сопровождается самопроизвольным раздроблением вещества на молекулы. Франческо установил, что процессы осаждения «псевдорастворов» (золей S, As2S3, AgCl и других) неспецифичны, протекают без заметной химической реакции и не сопровождаются изменением температуры и объема, в отличие от химического осаждения.
Получение золя As2S3:
2H3AsO3+ 3H2S → As2S3↓ + 6 H2O
Двухосновная сероводородная кислота является слабым электролитом, в растворе диссоциирует преимущественно по первой стадии
H2S↔HS–+H+,
поэтому потенциал-определяющими ионами в данном случае будут выступать ионы HS–. В связи с этим формулу образовавшейся мицеллы (рис. 1б) можно представить следующим образом:
{m[As2S3]n HS–(n – x) H+}–xxH+
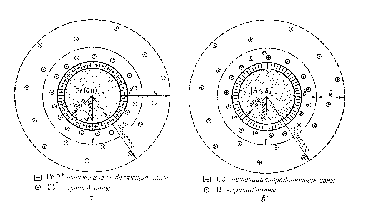
В качестве примера образования ДЭС путем поверхностной диссоциации можно рассмотреть строение мицеллы кремниевой кислоты, часть молекул которой, находясь на поверхности ядра, диссоциирует по уравнению:
H2SiO3↔H++HSiO3–
Причем ионы HSiO3–, прочно связанные с ядром, являются потенциалопределяющими. Роль противоионов выполняют подвижные ионы Н+, которые распределяются как в адсорбционном, так и в диффузном слоях. Схематическое строение коллоидной частицы данного золя можно представить следующим образом:
{m[H2SiO3]n HSiO3–(n – x) H+} xH+
Следует отметить, что мицеллы в золях не имеют строго определенного состава и обладают более сложным строением, которое предложенные нами формулы отражают со значительной степенью условности. Тем не менее, они позволяют интерпретировать многие свойства золей как в качественном, так и в количественном плане, и поэтому представляют определенный интерес.
Источники:
- Джуа М. История химии. – М.: Мир, 1966. 452 с.
- Болдырев А.И. Физическая и коллоидная химия,стр 279. 1983 г
- Захарченко В.Н. Коллоидная химия: Учеб. для медико-биолог. спец. вузов.— 2-е изд., перераб. и доп.— М: Высш. шк., 1989.—238 С.: ил.
- Свободная энциклопедия Wikipedia – http://ru.wikipedia.org.
- http://www.studfiles.ru/preview/5364604/page:12/
