Встает вопрос, за счет чего достигается столь высокая скорость и селективность транспорта воды? Ответ на этот вопрос связан с пониманием строения аквапоринов.
Аквапорины – небольшие, очень гидрофобные трансмембранные белки. Их отличительная особенность заключается в наличии внутренней гомологии между двумя половинами молекулы (рис 1).
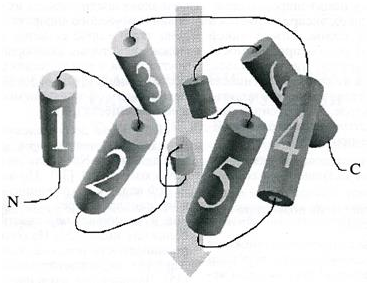
Трансмембранные α – спиральные домены пронумерованы. На двух соединительных петлях отмечены короткие α – спиральные домены. Области канала обозначены стрелками.
Шесть трансмембранных α-спиральных доменов белка формируют в плоскости мембраны «бочонок». N- и С-концы направлены в цитоплазму, и с их помощью осуществляется специфическая регуляция активности аквапорина. На одной из цитоплазматических и на одной из внешних соединительных цепей образуется два коротких α-спиральных домена, которые с противоположных сторон вставлены в «бочонок» навстречу друг другу. Эти домены участвуют в формировании водного канала. Их вершины тесно сближены внутри молекулы. На каждой из вершин содержится мотив NРА(Асн-Про-Ала), консервативный для всех аквапоринов, за редким исключением. Такая структура получила название «модели песочных часов» (hourglass model) .
Аквапорины образуют в мембране гомотетрамеры (рис. 2).
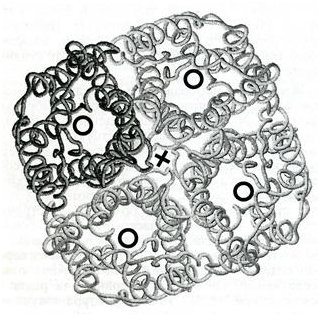
Водные каналы внутри мономеров обозначены черными кольцами, а предположительный участок ионного канала – крестом.
Каждая из четырех субъединиц в составе комплекса образует независимый водный канал, а катионная пара, обеспечивающая ионный транспорт, лежит вдоль оси тетрамера. Устойчивость четвертичной структуры отличается в разных филогенетических кластерах аквапоринов: тетрамеры аквапоринов с глицериновой специфичностью менее прочны.
Наиболее полные сведения о строении водного канала были получены после кристаллизации Aqp1 и его последующего рентгеноструктурного анализа (рис. 3).
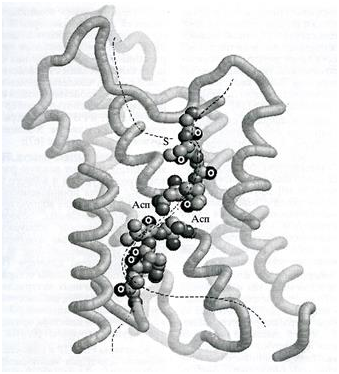
Внутренняя поверхность канала отмечена пунктиром. Карбонильные атомы кислорода (О) выстроены в цепь гидрофильных полей вдоль водной поры. В центре поры сближены остатки аспаргина (Асп) двух мотивов NPA. Обозначен атом серы (S), служащий мишенью для ртутных ингибиторов.
Канал аквапорина напоминает по форме гантель (или песочные часы). Он состоит из внешней и цитоплазматической воронок и соединяющей их узкой и длинной селективной поры. Поверхность воронок образована в основном полярными аминокислотными остатками. На ней происходит первичный отбор гидрофильных субстратов и их освобождение от гидратной оболочки за счет образования водородных связей с атомами белка. В области перехода внешней воронки в пору просвет канала резко сужен. Это стерический фильтр, не проницаемый для крупных незаряженных молекул и ионов, неспособных полностью освободиться своей гидратной оболочки. Диаметр сужения позволяет пройти через него только одиночным молекулам воды.
Чтобы прохождение воды по поре было термодинамически выгодным, в ходе него должны создаваться новые водородные связи между молекулой воды и атомами аквапорина. Со стороны белка связывание обеспечивают атомы кислорода пептидных групп нескольких последовательных аминокислотных остатков. Эти атомы расположены в две цепи вдоль внутренней поверхности поры, в остальном гидрофобной. Цепи начинаются одна от внешней, другая – от цитоплазматической воронки и идут навстречу друг другу к середине поры. Они образованы аминокислотами двух петель, содержащих короткие α-спиральные домены. Расстояние между гидрофильными полями имеет важное термодинамическое значение: более частое их расположение привело бы к росту числа промежуточных стадий транспорта, а более редкое – к увеличению энергии перехода от одной стадии к другой. В обоих случаях происходит снижение скорости транспорта воды.
Серединную область поры, расположенную в самом центре белка, формируют сближенные остатки аспарагина двух NРА-мотивов. Их амидные группы также образуют гидрофильные поля на поверхности канала. На участке перехода от одного аспарагинового остатка к другому молекула воды«вырывается» из непрерывной цепи водородных связей, которую она образовала вместе с другими молекулами воды, следующими за ней вдоль поры. Этому способствует изгиб поры и геометрия расположения гидрофильных полей. Разрыв единой трансмембранной системы водородных связей имеет большое значение для селективности канала, так как цепь из связанных между собой молекул воды может служить каналом для миграции протона. Такая миграция приводила бы к снижению в клетке трансмембранного электрохимического протонного градиента и нарушению окислительного фосфорилирования.
Источник
- Аквапорины: строение, систематика и особенности регуляции/ Шапигузов А.Ю. // Физиология растений. – 2004. – Т.51, №1. – С. 142-152.
