Флуоресце́нтные белки́, характеризуются способностью к интенсивной флуоресценции в узком спектральном диапазоне. Особенностью их структуры является наличие хромофорного элемента, ответственного за испускание света, который образуется без участия внешних кофакторов и ферментов путём посттрансляционных модификаций аминокислот.
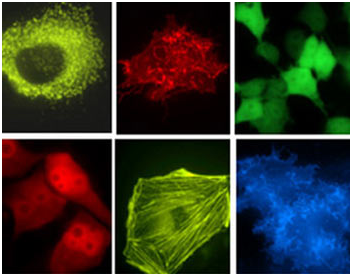
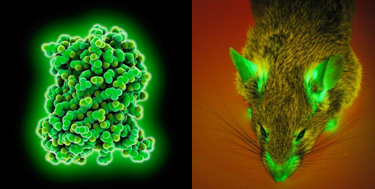
Green Fluorescent Protein (GFP) – зелёный флуоресцентный белок – был впервые выделен в 1961 году О. Шимомурой и коллегами из медузы Aequorea victoria, и уже в 1992 году была установлена первичная структура GFP. Спустя 2 года Chalfie и соавторы предложили использовать GFP в качестве генетически кодируемого флуоресцентного маркёра экспрессии генов. К настоящему времени различными группами исследователей найдены новые природные GFP-подобные белки и было создано большое число их мутантных вариантов. Это позволило значительно расширить диапазон применений флуоресцентных белков. Ряд GFP-подобных белков, преимущественно характеризующихся флуоресценцией в зелёной области спектра, был обнаружен в биолюминесцентных организмах, таких как Hydrozoa и Anthozoa. Повышенный фундаментальный и прикладной интерес к флуоресцентным белкам привел к обнаружению родственных белков в небиолюминисцентных коралловых полипах и морских анемонах. Эти белки имеют сходную с avGFP третичную структуру и обладают большим цветовым разнообразием, которое объясняется формированием различных по химической структуре хромофорных групп, а также различиями аминокислотного окружения хромофора. Интересно, что на сегодняшний день GFP-подобные белки обнаружены исключительно у морских организмов. Открытие и развитие множества спектральных вариантов флуоресцентных белков произвели революцию в исследовании живых систем. В 2008 году Нобелевская премия по химии была присуждена «за открытие и развитие зеленого флуоресцентного белка, GFP».
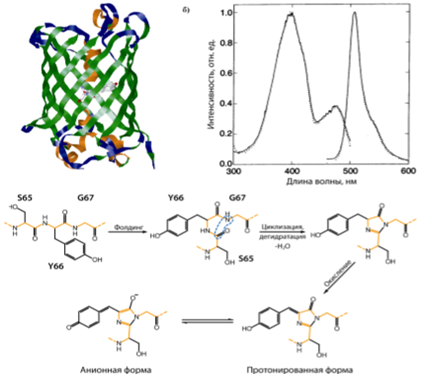
GFP дикого типа имеет молекулярную массу 27 кДа и состоит из 238 аминокислотных остатков. При кристаллизации GFP может сохранять способность к флуоресценции, что позволило определить трёхмерную структуру функциональной молекулы с помощью рентгеноструктурного анализа. Впервые кристаллическая структура белка GFP была расшифрована в 1996 году, и эта работа во многом прояснила механизм образования хромофора и роль окружающих аминокислот. GFP и GFP-подобные белки формируют внутренний хромофор без внешних ферментов и субстратов, используя только молекулярный кислород. Пространственная структура GFP представляет собой β-бочонок, образованный одиннадцатью β-слоями, внутри которого расположена α-спираль, несущая хромофор. Образование функционального хромофора происходит в составе белка посттрансляционно, в результате двух последовательных процессов: реакции циклизации между тремя аминокислотными остатками и последующего окисления хромофора с участием молекулярного кислорода. Третичная структура белка, благодаря своей компактности, создаёт оптимальные условия для защиты хромофора от внешних воздействий, чем объясняется высокая стабильность флуоресценции, устойчивость белка к действию протеаз, изменению pH и температуры. Сформировавшийся хромофор avGFP существует в двух формах – протонированной, с максимумом поглощения при 395 нм, и анионной, с максимумом поглощения при 470 нм. Исследования ФБ с использованием сайт-направленного и случайного мутагенеза показали, что флуоресценция зависит от трехмерной структуры аминокислотных остатков, окружающих хромофор. Денатурация белка, как и следовало ожидать, разрушает флуоресценцию, а мутации аминокислотных остатков, находящихся в непосредственной близости от хромофора, могут значительно изменить флуоресцентные свойства белка.
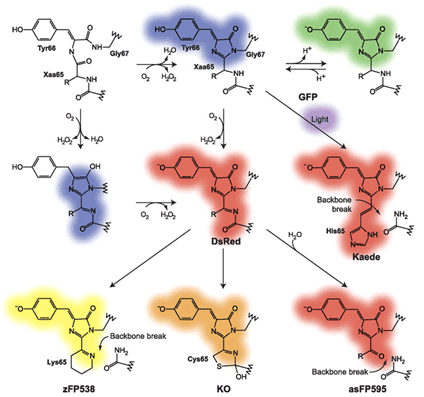
Источники:
1) https://bigenc.ru/chemistry/text/4716082
2) http://evrogen.ru/products/basicFPs.shtml
3) Шемякина, И. И. Красные и дальне-красные флуоресцентные белки, оптимизированные для мечения белков слияния: дисс. … канд. биолг. наук: 03.01.03 / Шемякина Ирина Игоревна. – Москва, 2015. – 101 с.
4) http://www.stormoff.ru/mediacenter/articles/article_93/
5) https://biomolecula.ru/articles/fluorestsentnye-belki-raznoobraznee-chem-vy-dumali
