Как мы помним, адсорбция — процесс самопроизвольного увеличения концентрации вещества на границе раздела фаз.
Адсорбция паров на пористых твердых сорбентах имеет ряд особенностей, связанных с размерами пор. Причем именно механизм адсорбционных процессов лежат в основе классификации пористых тел по размерам пор (классификация М.М. Дубинина). Для пористых сорбентов с размерами пор от 2 до 100 нм (мезопористые или переходно-пористые тела) характерна полимолекулярная адсорбция, которая с увеличением давления заканчивается капиллярной конденсацией. Капиллярная конденсация начинает проявляться при определенной степени заполнения адсорбента или при определенном давлении пара, характерном для данной системы. К этому моменту поверхностная энергия практически полностью скомпенсирована в результате полимолекулярной адсорбции, а микропоры заполнены адсорбатом.
Капиллярная конденсация обусловлена проявлением капиллярных сил, что связано со сродством адсорбата к адсорбенту. Основываясь на закономерностях капиллярных явлений, можно утверждать, что сродство должно быть достаточно для смачивания поверхности твердого тела жидкостью, появляющейся в результате конденсации в порах. Только в случае смачивания адсорбент будет втягивать в поры адсорбат, увеличивая тем самым адсорбцию. Чем меньше размер пор, тем сильнее капиллярное удерживание адсорбата. Если поверхность не смачивается, то наблюдается явление капиллярного выталкивания, адсорбция в этом случае минимальна и возможна только в крупных порах.
В адсорбентах с порами капиллярных размеров на стенках пор вначале образуется мономолекулярный, затем двойной и последующие слои адсорбата. Тем самым на стенке постепенно создается вогнутая поверхность жидкости, в которую превратился адсорбированный пар. Радиус кривизны поверхности постепенно уменьшается по мере утолщения слоя жидкости на стенках. Этот слой жидкости находится в равновесии с паром, заполняющим поровое пространство.
В случае плоской границы раздела фаз конденсация пара в жидкость при данной температуре происходит, когда давление становится равным давлению насыщенного пара, то есть при P/PS = 1. Конденсация над вогнутой поверхностью в порах происходит при несколько меньшем давлении насыщенного пара, то есть при P/PS < 1.
Давление насыщенного пара над искривленной поверхностью отличается от давления насыщенного пара над плоской поверхностью, что приводит к изменению химического потенциала над искривленной поверхностью и изменяет условия фазового равновесия в порах. Условием фазового равновесия является равенство химических потенциалов пара и жидкости:
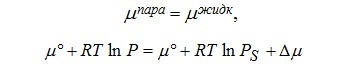
где P давление насыщенного пара над искривленной поверхностью, PS — давление насыщенного пара над плоской поверхностью. Приращение химического потенциала за счет лапласова давления при изменении кривизны поверхности для однокомпонентной системы в изотермических условиях соответствует работе расширения:
После подстановок и необходимых преобразований получаем уравнение Томсона (Кельвина), связывающее давление P, при котором пар будет насыщенным по отношению к искривленной поверхности, c радиусом кривизны r:
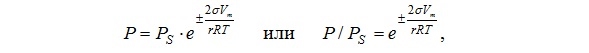
На изотерме адсорбции этот участок проявляется в виде резкого подъема (изотермы IV и V типа), положение которого зависит от радиуса пор.Размеры радиусов менисков подчиняются уравнению капиллярной конденсации Томсона (Кельвина).
ln (P/Ps) = ± (2σVm) / (rRT)
где P — давление пара над искривленным мениском;
Ps — давление насыщенного пара над плоской поверхностью ;
s — поверхностное натяжение конденсированной жидкости;
r — радиус кривизны мениска.
σ — поверхностное натяжение жидкости, образов. при конденсации пара
R — газовая постоянная
Vm — молярный объем жидкости
Из уравнения видно, что при смачивании обеспечивается отрицательная кривизна мениска конденсата (вогнутый мениск), конденсация в порах наступает при давлении , которое меньше давления насыщенного пара , т.е. р/рs<1. Капиллярная конденсация не является следствием адсорбционных сил адсорбента и адсорбата в капилляре, но адсорбция является первым этапом капиллярной конденсации, если адсорбционные силы очень велики, а капилляры очень узкие, то конденсация идет до тех пор, пока не будет достигнуто давление насыщения над поверхностью.
Капиллярное давление:
где φ — относительное давление пара, равное отношению давления пара на поверхности жидкости ρп к давлению насыщенного пара свободной жидкости ρ0 (давление над свободной поверхностью жидкости).
Если перепад давления Δρж определяется кривизной поверхности жидкости, то
Для вогнутого мениска r’1=r’2=r’ и
Формула Томсона может быть применена для капилляров, радиус которых лежит в пределах 0,5•10-7<10-5 см.
Нижний предел обусловлен размерами молекул тела, так как если радиус капилляра сравним с радиусом молекул ≈108 см, то соотношение теряет свой физический смысл. Для капилляров с радиусом, большим 10 см, давление насыщенного пара над мениском капилляра практически равно давлению насыщенного пара над плоской поверхностью.
Формула Томсона проверялась прямыми экспериментами. К. В. Чмутов опытами по капиллярной конденсации паров различных жидкостей в щели показал, что формула Томсона не применима к вычислению радиусов пор сорбентов.
Таким образом, значения радиусов цилиндрического капилляра, получаемые по последней формуле в зависимости от относительной упругости пара надо считать грубо ориентировочными.
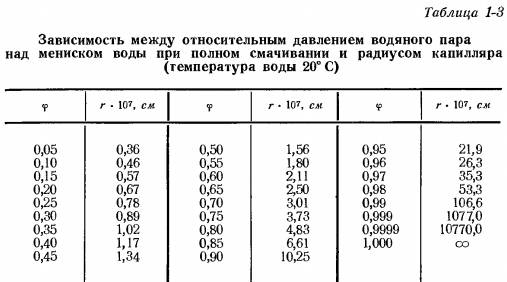
Из таблицы 1-3 видно, что при φ = 0,1 (давление насыщенного пара над мениском капилляра в 10 раз меньше давления насыщенного пара над плоской поверхностью) радиус капилляра равен 0,46•10-7 см. Для капилляра радиусом r = 1,07•10-5 см давление насыщенного пара практически не отличается от давления насыщенного пара над плоской поверхностью с точностью до 1 %.
Такой вывод послужил одной из причин, позволяющих считать капилляры с радиусом r>10-5 см макрокапиллярами в отличие от микрокапилляров, радиус которых r<105 см.
Источники:
1) Матвеев А.Н. Молекулярная физика: Учеб. Пособие для вузов. –М: Высшая школа,1981.
2) Адсорбционные явления и поверхность (Рощина Т.М. , 1998), Химия. (Статья Соросовского образовательного журнала)
