Уравнение Ленгмюра можно использовать только при отсутствии адсорбции вещества сверх мономолекулярного слоя. Это условие выполняется достаточно строго при хемосорбции, физической адсорбции газов при небольших давлениях и температурах выше критической, а часто и при адсорбции из растворов. Указанные ограничения для применения уравнения Ленгмюра связаны не столько с формальным описанием адсорбции, сколько с невозможностью получить правильные значения адсорбционного коэффициента и емкости монослоя, соответствующие их физическому смыслу.
В большинстве случаев реальная поверхность твердого тела не вполне однородна энергетически; адсорбция, как правило, не является строго локализованной; адсорбированные молекулы практически всегда взаимодействуют между собой; наконец, стехиометрия может нарушаться, вследствие чего адсорбция не будет ограничена образованием одного слоя. Поэтому реальные изотермы адсорбции всегда отклоняются от изотермы Ленгмюра. Еще самим Ленгмюром было показано, что если адсорбционные центры считать энергетически неоднородными, то суммарная адсорбция на всех центрах будет выражена следующим уравнением:
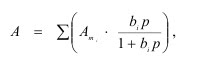
где i — количество групп одинаковых центров.
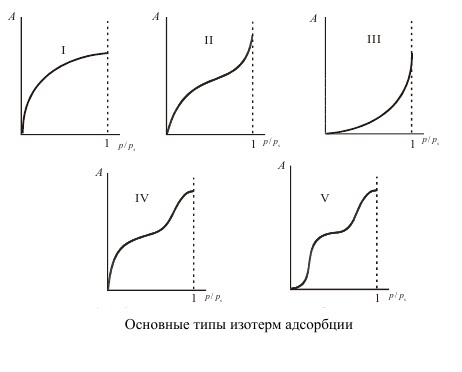
Брунауэр, Эммет и Теллер отказались от второго допущения Ленгмюра, приводящего к мономолекулярной адсорбции. Для случая, когда температура адсорбтива ниже критической (то есть, это еще пар) они разработали теорию полимолекулярной адсорбции. После анализа многочисленных реальных изотерм адсорбции ими была предложена их классификация на основе выделения пяти основных типов изотерм.
Изотермы типа I отражают мономолекулярную адсорбцию. Изотермы типа II и III обычно связывают с образованием при адсорбции многих слоев, то есть, с полимолекулярной адсорбцией. Причем, в случае II взаимодействие адсорбент — адсорбат сильнее взаимодействия адсорбат — адсорбат, а в случае III — наоборот. Изотермы типа IV и V отличаются тем, что для них характерна конечная адсорбция при приближении давления пара к давлению насыщения ps. Изотермы типа II и III характерны для адсорбции на не пористом адсорбенте, а типа IV и V — на пористом твердом теле. Все пять типов изотерм адсорбции описываются теорией полимолекулярной адсорбции “БЭТ”, названной так по начальным буквам фамилий ее авторов.
Теория БЭТ сохраняет ленгмюровские представления о динамическом характере адсорбции. Адсорбция считается полислойной. Молекулы первого слоя адсорбируются на поверхности адсорбента в результате межмолекулярного взаимодействия адсорбент — адсорбат. Каждая адсорбированная молекула первого адсорбционного слоя может, в свою очередь, являться центром адсорбции молекул второго слоя и т.д. Так формируются второй и последующие сорбционные слои. Теплота адсорбции в первом слое q1 определяется взаимодействием адсорбат — адсорбент, во всех последующих слоях — взаимодействием адсорбат — адсорбат. Поэтому теплота адсорбции во всех слоях, начиная со второго, равна теплоте конденсации λ. Второй и последующие адсорбционные слои могут начинать образовываться и при незавершенном первом слое, как это показано на рисунке:
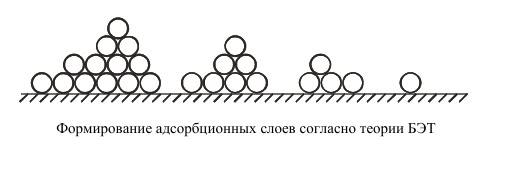
Если обозначить через S0, S1, S2 … площади поверхности адсорбента, покрытые 0, 1, 2 … слоями адсорбированных молекул, то вся площадь адсорбента будет равна сумме площадей с разным числом слоев:
Sобщ = Σ Si .
Составив уравнение адсорбционного равновесия для каждого слоя и просуммировав их, авторы теории БЭТ получили уравнение для полислойной адсорбции:
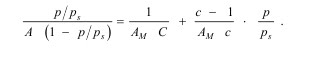
В приведенном уравнении АМ — емкость монослоя, С — константа, равная е (q1− λ) / RT. При малых относительных давлениях, когда р << рs, уравнение преобразуется в уравнение Ленгмюра.
Таким образом, изотерма Ленгмюра (изотерма I) может рассматриваться как частный случай уравнения БЭТ. В случаях, когда q1 > λ , т.е. энергия взаимодействия адсорбент — адсорбат больше энергии взаимодействия адсорбат — адсорбат, изотерма адсорбции выпукла и относится к типу II или IV. Если же энергия взаимодействия адсорбат — адсорбат больше теплоты адсорбции (λ > q1), то изотерма адсорбции вогнута и относится к типу III или V.
Уравнение изотермы адсорбции БЭТ широко используется для определения величины удельной поверхности адсорбентов. Изотерма адсорбции выражается прямой линией, отсекающей на оси ординат отрезок, равный 1 / АМ С , а тангенс угла ее наклона к оси абсцисс равен (С − 1) / АМ С.
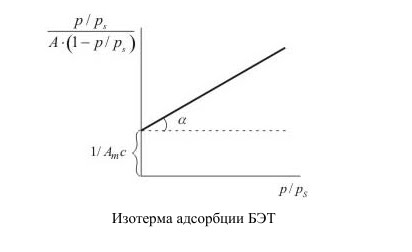
Из этих значений можно найти величину АМ, а зная ее, рассчитать по уравнению удельную поверхность адсорбента. Стандартной методикой для определения удельной поверхности адсорбентов принято считать измерение изотермы адсорбции азота при 77К. В этом случае wо = 0.162 нм2.
Источники:
- Пальтиель Л.Р., Зенин Г.С., Волынец Н.Ф. КОЛЛОИДНАЯ ХИМИЯ: Учеб. пособие. – СПб: СЗТУ, 2004. – 68 с.
- Кукушкина И.И., Митрофанов А.Ю. Коллоидная химия, Кемерово:2009 — 185 с.
